Осмос | это… Что такое Осмос?
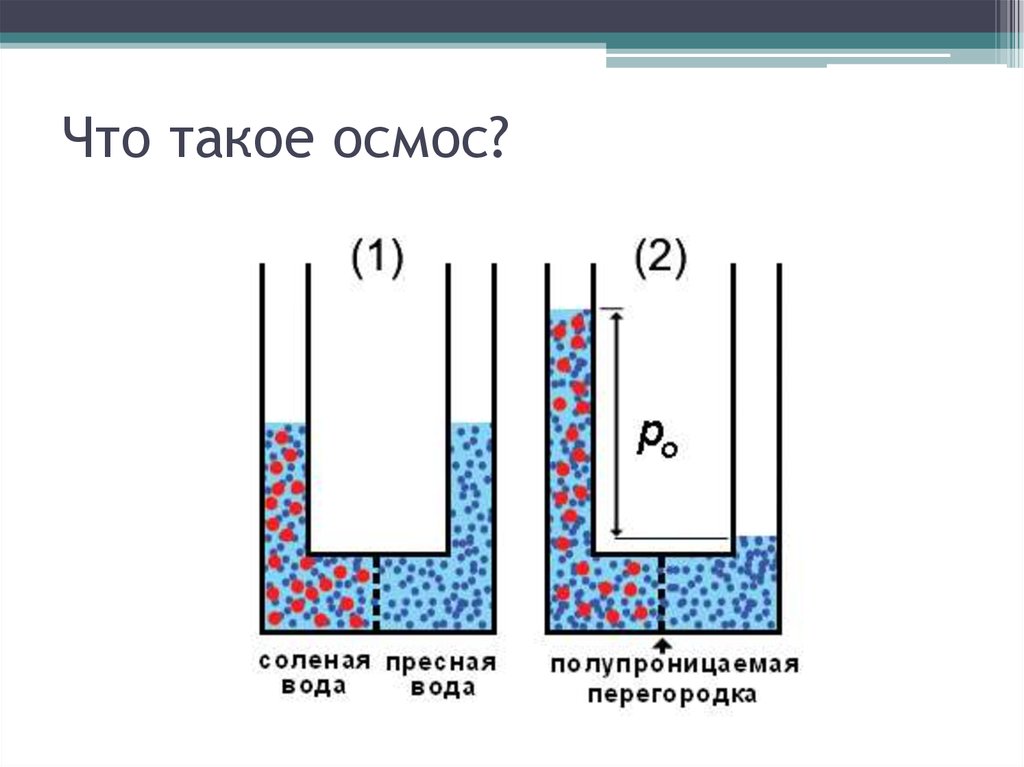
О́смос (от греч. ὄσμος — толчок, давление) — процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону бо́льшей концентрации растворённого вещества (меньшей концентрации растворителя).
Более широкое толкование явления осмоса основано на применении Принципа Ле Шателье — Брауна: если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
Жан-Антуан Нолле
Содержание
|
История
Впервые осмос наблюдал А. Нолле в 1748, однако исследование этого явления было начато спустя столетие.
Суть процесса
Рис. 1. Осмос через полупроницаемую мембрану. Частицы растворителя (синие) способны пересекать мембрану, частицы растворённого вещества (красные) — нет.
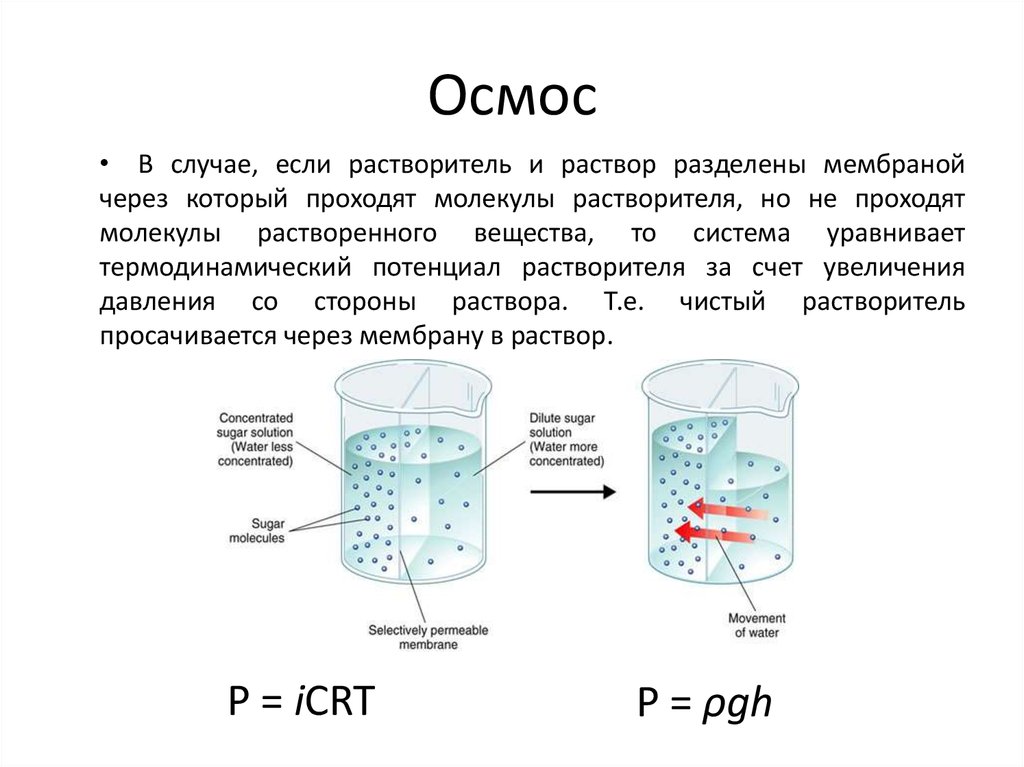
Явление осмоса наблюдается в тех средах, где подвижность растворителя больше подвижности растворённых веществ. Важным частным случаем осмоса является осмос через полупроницаемую мембрану. Полупроницаемыми называют мембраны, которые имеют достаточно высокую проницаемость не для всех, а лишь для некоторых веществ, в частности, для растворителя. (Подвижность растворённых веществ в мембране стремится к нулю). Как правило, это связано с размерами и подвижностью молекул, например, молекула воды меньше большинства молекул растворённых веществ. Если такая мембрана разделяет раствор и чистый растворитель, то концентрация растворителя в растворе оказывается менее высокой, поскольку там часть его молекул замещена на молекулы растворённого вещества (см. Рис. 1). Вследствие этого, переходы частиц растворителя из отдела, содержащего чистый растворитель, в раствор будут происходить чаще, чем в противоположном направлении. Соответственно, объём раствора будет увеличиваться (а концентрация вещества уменьшаться), тогда как объём растворителя будет соответственно уменьшаться.
Соответственно, объём раствора будет увеличиваться (а концентрация вещества уменьшаться), тогда как объём растворителя будет соответственно уменьшаться.
Например, к яичной скорлупе с внутренней стороны прилегает полупроницаемая мембрана: она пропускает молекулы воды и задерживает молекулы сахара. Если такой мембраной разделить растворы сахара с концентрацией 5 и 10 % соответственно, то через нее в обоих направлениях будут проходить только молекулы воды. В результате в более разбавленном растворе концентрация сахара повысится, а в более концентрированном, наоборот, понизится. Когда концентрация сахара в обоих растворах станет одинаковой, наступит равновесие. Растворы, достигшие равновесия, называются изотоническими. Если принять меры, чтобы концентрации не менялись, осмотическое давление достигнет постоянной величины, когда обратный поток молекул воды сравняется с прямым.
Осмос, направленный внутрь ограниченного объёма жидкости, называется эндосмосом, наружу — экзосмосом.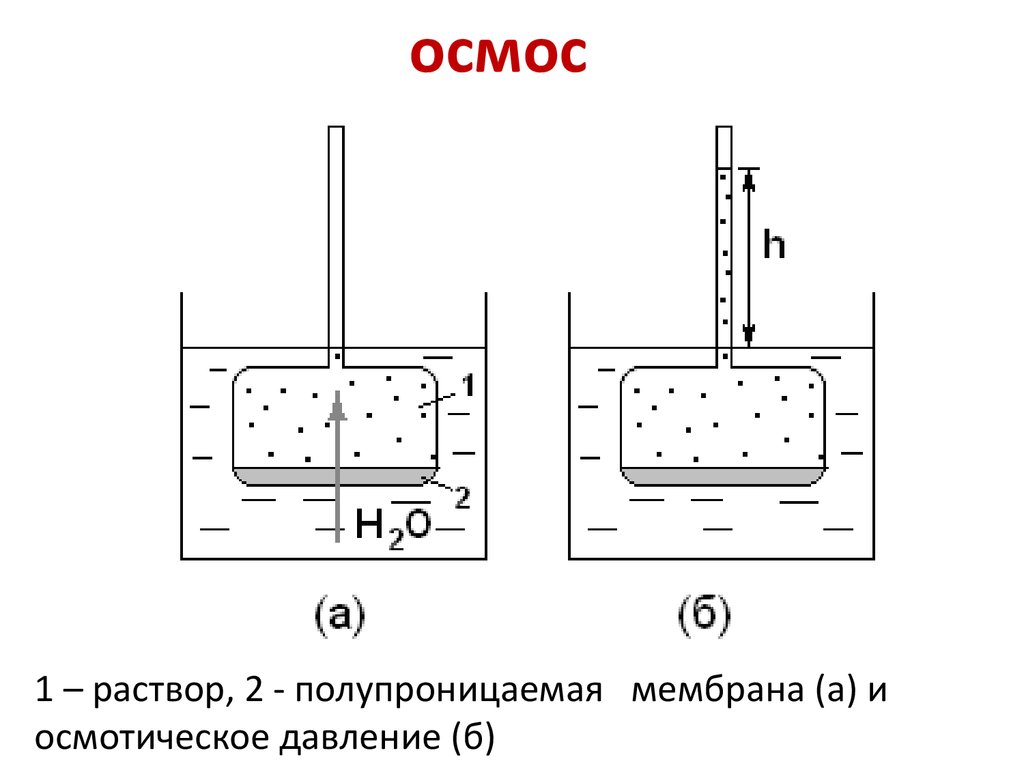 Перенос растворителя через мембрану обусловлен осмотическим давлением. Это осмотическое давление возникает соответственно Принципу Ле Шателье из-за того, что система пытается выравнять концентрацию раствора в обоих средах, разделенных мембраной, и описывается вторым законом термодинамики. Оно равно избыточному внешнему давлению, которое следует приложить со стороны раствора, чтобы прекратить процесс, то есть создать условия осмотического равновесия. Превышение избыточного давления над осмотическим может привести к обращению осмоса — обратной диффузии растворителя.
Перенос растворителя через мембрану обусловлен осмотическим давлением. Это осмотическое давление возникает соответственно Принципу Ле Шателье из-за того, что система пытается выравнять концентрацию раствора в обоих средах, разделенных мембраной, и описывается вторым законом термодинамики. Оно равно избыточному внешнему давлению, которое следует приложить со стороны раствора, чтобы прекратить процесс, то есть создать условия осмотического равновесия. Превышение избыточного давления над осмотическим может привести к обращению осмоса — обратной диффузии растворителя.
В случаях, когда мембрана проницаема не только для растворителя, но и для некоторых растворённых веществ, перенос последних из раствора в растворитель позволяет осуществить диализ, применяемый как способ очистки полимеров и коллоидных систем от низкомолекулярных примесей, например электролитов.
Значение осмоса
Осмос играет важную роль во многих биологических процессах. Мембрана, окружающая нормальную клетку крови, проницаема лишь для молекул воды, кислорода, некоторых из растворённых в крови питательных веществ и продуктов клеточной жизнедеятельности; для больших белковых молекул, находящихся в растворённом состоянии внутри клетки, она непроницаема. Поэтому белки, столь важные для биологических процессов, остаются внутри клетки.
Поэтому белки, столь важные для биологических процессов, остаются внутри клетки.
Осмос участвует в переносе питательных веществ в стволах высоких деревьев, где капиллярный перенос не способен выполнить эту функцию.
Осмос широко используют в лабораторной технике: при определении молярных характеристик полимеров, концентрировании растворов, исследовании разнообразных биологических структур. Осмотические явления иногда используются в промышленности, например при получении некоторых полимерных материалов, очистке высоко-минерализованной воды методом обратного осмоса жидкостей.
Клетки растений используют осмос также для увеличения объёма вакуоли, чтобы она распирала стенки клетки (тургорное давление). Клетки растений делают это путём запасания сахарозы. Увеличивая или уменьшая концентрацию сахарозы в цитоплазме, клетки могут регулировать осмос. За счёт этого повышается упругость растения в целом. С изменениями тургорного давления связаны многие движения растений (например, движения усов гороха и других лазающих растений). Пресноводные простейшие также имеют вакуоль, но задача вакуолей простейших заключается лишь в откачивании лишней воды из цитоплазмы для поддержания постоянной концентрации растворённых в ней веществ.
Пресноводные простейшие также имеют вакуоль, но задача вакуолей простейших заключается лишь в откачивании лишней воды из цитоплазмы для поддержания постоянной концентрации растворённых в ней веществ.
Осмос также играет большую роль в экологии водоёмов. Если концентрация соли и других веществ в воде поднимется или упадёт, то обитатели этих вод погибнут из-за пагубного воздействия осмоса.
Использование в промышленности
Первая в мире электростанция — прототип, использующая для выработки электричества явление осмоса, запущена компанией Statkraft 24 ноября 2009 года в Норвегии вблизи города Тофте. Солёная морская и пресная вода на электростанции разделены мембраной; так как концентрация солей в морской воде выше, между солёной водой моря и пресной водой фьорда развивается явление осмоса, — постоянный поток молекул воды через мембрану в сторону солёной воды. В результате чего давление солёной воды возрастает.[1] Это давление соответствует давлению столба воды в 120 метров высотой, то есть достаточно высокому водопаду. Поток воды достаточен, чтобы приводить в действие гидротурбину, вырабатывающую энергию.[2] Производство носит ограниченный характер, основная цель — тестирование оборудования. Самый проблематичный компонент электростанции — мембраны. По оценкам специалистов Statkraft мировое производство может составить от 1 600 до 1 700 TWh, что сравнимо с потреблением Китая в 2002. Ограничение связано с принципом действия — подобные электростанции могут быть построены только на морском побережье.[3] Это не вечный двигатель, источником энергии является энергия солнца. Солнечное тепло отделяет воду от моря при испарении и посредством ветра переносит на сушу. Потенциальная энергия используется на гидроэлектростанциях, а химическая энергия долго оставалась без внимания.
Поток воды достаточен, чтобы приводить в действие гидротурбину, вырабатывающую энергию.[2] Производство носит ограниченный характер, основная цель — тестирование оборудования. Самый проблематичный компонент электростанции — мембраны. По оценкам специалистов Statkraft мировое производство может составить от 1 600 до 1 700 TWh, что сравнимо с потреблением Китая в 2002. Ограничение связано с принципом действия — подобные электростанции могут быть построены только на морском побережье.[3] Это не вечный двигатель, источником энергии является энергия солнца. Солнечное тепло отделяет воду от моря при испарении и посредством ветра переносит на сушу. Потенциальная энергия используется на гидроэлектростанциях, а химическая энергия долго оставалась без внимания.
Примечания
- ↑ Солёный киловатт
- ↑ Информация об открытии осмотической электростанции
- ↑ Statkraft представляет работу электростанции, видео
Ссылки
- Осмос в ЭСБЕ
- Осмос в БСЭ
Осмос | это.
 .. Что такое Осмос?
.. Что такое Осмос?О́смос (от греч. ὄσμος — толчок, давление) — процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону бо́льшей концентрации растворённого вещества (меньшей концентрации растворителя).
Более широкое толкование явления осмоса основано на применении Принципа Ле Шателье — Брауна: если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
Жан-Антуан Нолле
Содержание
|
История
Впервые осмос наблюдал А. Нолле в 1748, однако исследование этого явления было начато спустя столетие.
Суть процесса
Рис. 1. Осмос через полупроницаемую мембрану. Частицы растворителя (синие) способны пересекать мембрану, частицы растворённого вещества (красные) — нет.
Явление осмоса наблюдается в тех средах, где подвижность растворителя больше подвижности растворённых веществ. Важным частным случаем осмоса является осмос через полупроницаемую мембрану. Полупроницаемыми называют мембраны, которые имеют достаточно высокую проницаемость не для всех, а лишь для некоторых веществ, в частности, для растворителя. (Подвижность растворённых веществ в мембране стремится к нулю). Как правило, это связано с размерами и подвижностью молекул, например, молекула воды меньше большинства молекул растворённых веществ. Если такая мембрана разделяет раствор и чистый растворитель, то концентрация растворителя в растворе оказывается менее высокой, поскольку там часть его молекул замещена на молекулы растворённого вещества (см. Рис. 1). Вследствие этого, переходы частиц растворителя из отдела, содержащего чистый растворитель, в раствор будут происходить чаще, чем в противоположном направлении. Соответственно, объём раствора будет увеличиваться (а концентрация вещества уменьшаться), тогда как объём растворителя будет соответственно уменьшаться.
Соответственно, объём раствора будет увеличиваться (а концентрация вещества уменьшаться), тогда как объём растворителя будет соответственно уменьшаться.
Например, к яичной скорлупе с внутренней стороны прилегает полупроницаемая мембрана: она пропускает молекулы воды и задерживает молекулы сахара. Если такой мембраной разделить растворы сахара с концентрацией 5 и 10 % соответственно, то через нее в обоих направлениях будут проходить только молекулы воды. В результате в более разбавленном растворе концентрация сахара повысится, а в более концентрированном, наоборот, понизится. Когда концентрация сахара в обоих растворах станет одинаковой, наступит равновесие. Растворы, достигшие равновесия, называются изотоническими. Если принять меры, чтобы концентрации не менялись, осмотическое давление достигнет постоянной величины, когда обратный поток молекул воды сравняется с прямым.
Осмос, направленный внутрь ограниченного объёма жидкости, называется эндосмосом, наружу — экзосмосом. Перенос растворителя через мембрану обусловлен осмотическим давлением. Это осмотическое давление возникает соответственно Принципу Ле Шателье из-за того, что система пытается выравнять концентрацию раствора в обоих средах, разделенных мембраной, и описывается вторым законом термодинамики. Оно равно избыточному внешнему давлению, которое следует приложить со стороны раствора, чтобы прекратить процесс, то есть создать условия осмотического равновесия. Превышение избыточного давления над осмотическим может привести к обращению осмоса — обратной диффузии растворителя.
Перенос растворителя через мембрану обусловлен осмотическим давлением. Это осмотическое давление возникает соответственно Принципу Ле Шателье из-за того, что система пытается выравнять концентрацию раствора в обоих средах, разделенных мембраной, и описывается вторым законом термодинамики. Оно равно избыточному внешнему давлению, которое следует приложить со стороны раствора, чтобы прекратить процесс, то есть создать условия осмотического равновесия. Превышение избыточного давления над осмотическим может привести к обращению осмоса — обратной диффузии растворителя.
В случаях, когда мембрана проницаема не только для растворителя, но и для некоторых растворённых веществ, перенос последних из раствора в растворитель позволяет осуществить диализ, применяемый как способ очистки полимеров и коллоидных систем от низкомолекулярных примесей, например электролитов.
Значение осмоса
Осмос играет важную роль во многих биологических процессах. Мембрана, окружающая нормальную клетку крови, проницаема лишь для молекул воды, кислорода, некоторых из растворённых в крови питательных веществ и продуктов клеточной жизнедеятельности; для больших белковых молекул, находящихся в растворённом состоянии внутри клетки, она непроницаема. Поэтому белки, столь важные для биологических процессов, остаются внутри клетки.
Поэтому белки, столь важные для биологических процессов, остаются внутри клетки.
Осмос участвует в переносе питательных веществ в стволах высоких деревьев, где капиллярный перенос не способен выполнить эту функцию.
Осмос широко используют в лабораторной технике: при определении молярных характеристик полимеров, концентрировании растворов, исследовании разнообразных биологических структур. Осмотические явления иногда используются в промышленности, например при получении некоторых полимерных материалов, очистке высоко-минерализованной воды методом обратного осмоса жидкостей.
Клетки растений используют осмос также для увеличения объёма вакуоли, чтобы она распирала стенки клетки (тургорное давление). Клетки растений делают это путём запасания сахарозы. Увеличивая или уменьшая концентрацию сахарозы в цитоплазме, клетки могут регулировать осмос. За счёт этого повышается упругость растения в целом. С изменениями тургорного давления связаны многие движения растений (например, движения усов гороха и других лазающих растений). Пресноводные простейшие также имеют вакуоль, но задача вакуолей простейших заключается лишь в откачивании лишней воды из цитоплазмы для поддержания постоянной концентрации растворённых в ней веществ.
Пресноводные простейшие также имеют вакуоль, но задача вакуолей простейших заключается лишь в откачивании лишней воды из цитоплазмы для поддержания постоянной концентрации растворённых в ней веществ.
Осмос также играет большую роль в экологии водоёмов. Если концентрация соли и других веществ в воде поднимется или упадёт, то обитатели этих вод погибнут из-за пагубного воздействия осмоса.
Использование в промышленности
Первая в мире электростанция — прототип, использующая для выработки электричества явление осмоса, запущена компанией Statkraft 24 ноября 2009 года в Норвегии вблизи города Тофте. Солёная морская и пресная вода на электростанции разделены мембраной; так как концентрация солей в морской воде выше, между солёной водой моря и пресной водой фьорда развивается явление осмоса, — постоянный поток молекул воды через мембрану в сторону солёной воды. В результате чего давление солёной воды возрастает.[1] Это давление соответствует давлению столба воды в 120 метров высотой, то есть достаточно высокому водопаду.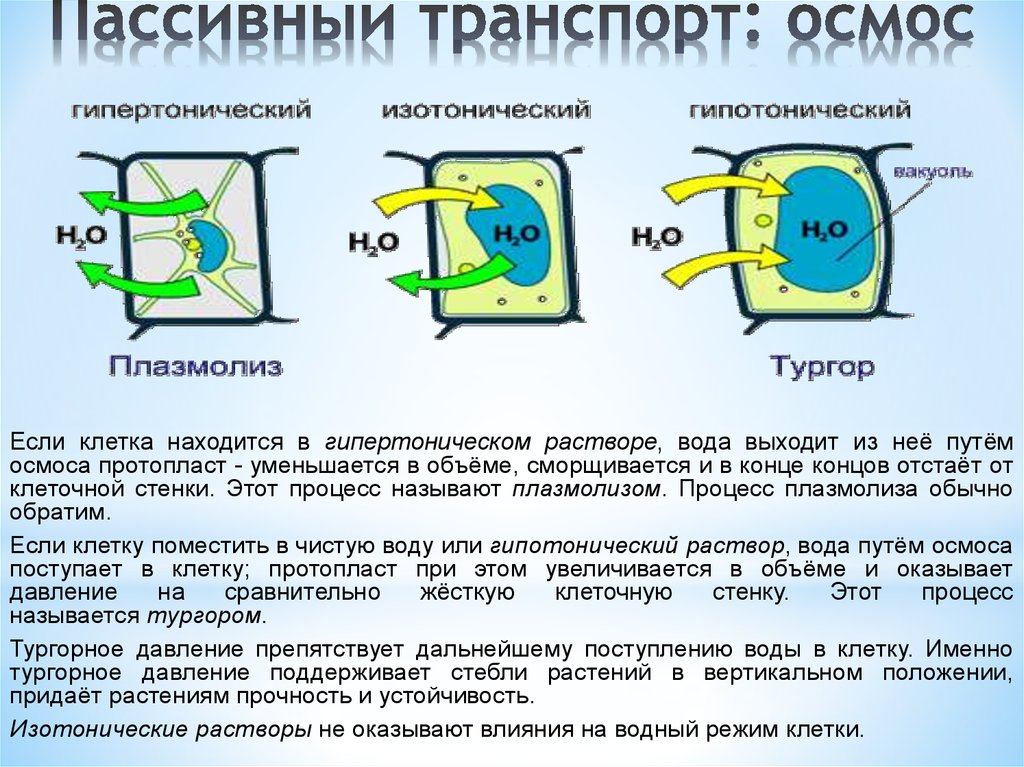 Поток воды достаточен, чтобы приводить в действие гидротурбину, вырабатывающую энергию.[2] Производство носит ограниченный характер, основная цель — тестирование оборудования. Самый проблематичный компонент электростанции — мембраны. По оценкам специалистов Statkraft мировое производство может составить от 1 600 до 1 700 TWh, что сравнимо с потреблением Китая в 2002. Ограничение связано с принципом действия — подобные электростанции могут быть построены только на морском побережье.[3] Это не вечный двигатель, источником энергии является энергия солнца. Солнечное тепло отделяет воду от моря при испарении и посредством ветра переносит на сушу. Потенциальная энергия используется на гидроэлектростанциях, а химическая энергия долго оставалась без внимания.
Поток воды достаточен, чтобы приводить в действие гидротурбину, вырабатывающую энергию.[2] Производство носит ограниченный характер, основная цель — тестирование оборудования. Самый проблематичный компонент электростанции — мембраны. По оценкам специалистов Statkraft мировое производство может составить от 1 600 до 1 700 TWh, что сравнимо с потреблением Китая в 2002. Ограничение связано с принципом действия — подобные электростанции могут быть построены только на морском побережье.[3] Это не вечный двигатель, источником энергии является энергия солнца. Солнечное тепло отделяет воду от моря при испарении и посредством ветра переносит на сушу. Потенциальная энергия используется на гидроэлектростанциях, а химическая энергия долго оставалась без внимания.
Примечания
- ↑ Солёный киловатт
- ↑ Информация об открытии осмотической электростанции
- ↑ Statkraft представляет работу электростанции, видео
Ссылки
- Осмос в ЭСБЕ
- Осмос в БСЭ
Физиология, осмос — StatPearls — Книжная полка NCBI
Книжная полка NCBI. Служба Национальной медицинской библиотеки, Национальных институтов здоровья.
Служба Национальной медицинской библиотеки, Национальных институтов здоровья.
StatPearls [Интернет]. Остров сокровищ (Флорида): StatPearls Publishing; 2022 янв.
StatPearls [Интернет].
Показать подробности
Критерий поиска
Майкл Дж. Лопес; Кэрри А. Холл.
Информация об авторе
Последнее обновление: 18 марта 2022 г.
Введение
В физиологии осмос (от греческого «толчок») — это чистое движение воды через полупроницаемую мембрану.[1][2] Через эту мембрану вода будет стремиться перемещаться из области с высокой концентрацией в область с низкой концентрацией. Важно подчеркнуть, что идеальный осмос требует только движения чистой воды через мембрану без какого-либо движения растворенных частиц через полупроницаемую мембрану. Осмос все еще может происходить при некоторой проницаемости частиц растворенного вещества, но осмотический эффект снижается при большей проницаемости растворенного вещества через полупроницаемую мембрану.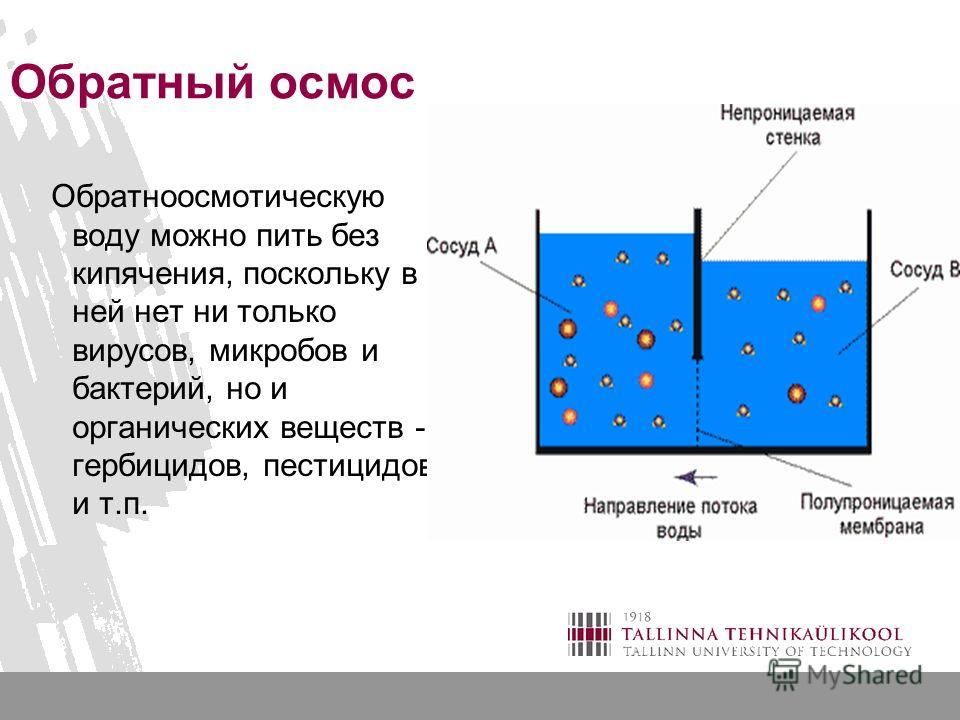 Верно также и то, что в определенный момент времени молекулы воды могут двигаться к раствору с более высокой или более низкой концентрацией, но чистое движение воды будет направлено к более высокой концентрации растворенного вещества. Отсек с самой высокой концентрацией растворенного вещества и самой низкой концентрацией воды имеет наибольшее осмотическое давление. Осмотическое давление можно рассчитать с помощью уравнения Ван-т-Гоффа, в котором говорится, что осмотическое давление зависит от количества частиц растворенного вещества, температуры и того, насколько хорошо частица растворенного вещества может перемещаться через мембрану. Его измеренная осмоляльность может описать осмотическое давление раствора. Осмоляльность раствора описывает, сколько частиц растворено в растворе. Коэффициент отражения полупроницаемой мембраны описывает, насколько хорошо растворенные вещества проникают через мембрану. Этот коэффициент находится в диапазоне от 0 до 1. Коэффициент отражения, равный 1, означает, что растворенное вещество непроницаемо.
Верно также и то, что в определенный момент времени молекулы воды могут двигаться к раствору с более высокой или более низкой концентрацией, но чистое движение воды будет направлено к более высокой концентрации растворенного вещества. Отсек с самой высокой концентрацией растворенного вещества и самой низкой концентрацией воды имеет наибольшее осмотическое давление. Осмотическое давление можно рассчитать с помощью уравнения Ван-т-Гоффа, в котором говорится, что осмотическое давление зависит от количества частиц растворенного вещества, температуры и того, насколько хорошо частица растворенного вещества может перемещаться через мембрану. Его измеренная осмоляльность может описать осмотическое давление раствора. Осмоляльность раствора описывает, сколько частиц растворено в растворе. Коэффициент отражения полупроницаемой мембраны описывает, насколько хорошо растворенные вещества проникают через мембрану. Этот коэффициент находится в диапазоне от 0 до 1. Коэффициент отражения, равный 1, означает, что растворенное вещество непроницаемо.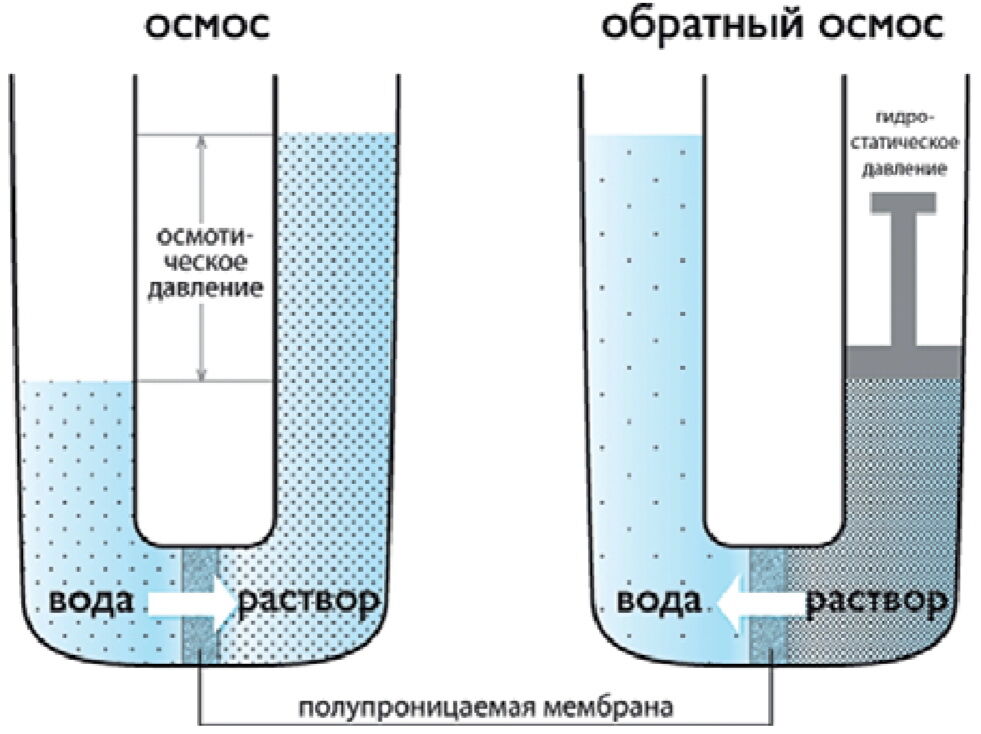 Коэффициент отражения, равный 0, означает, что растворенное вещество может свободно проникать, и растворенное вещество не может создавать осмотическое давление через мембрану.[2] Отделение с наибольшим осмотическим давлением будет втягивать воду и стремится уравнять разницу концентрации растворенного вещества между отсеками. Физической движущей силой осмоса является увеличение энтропии, создаваемое движением свободных молекул воды. Также считается, что взаимодействие частиц растворенного вещества с порами мембран участвует в создании отрицательного давления, то есть осмотического давления, управляющего потоком воды.[3] Обратный осмос возникает, когда вода течет в противоположном направлении. При обратном осмосе вода поступает в отделение с более низким осмотическим давлением и более высокой концентрацией воды. Такое течение возможно только при приложении к системе внешней силы. Обратный осмос обычно используется для очистки питьевой воды и требует затрат энергии. [4] Концепцию осмоса не следует путать с диффузией.
Коэффициент отражения, равный 0, означает, что растворенное вещество может свободно проникать, и растворенное вещество не может создавать осмотическое давление через мембрану.[2] Отделение с наибольшим осмотическим давлением будет втягивать воду и стремится уравнять разницу концентрации растворенного вещества между отсеками. Физической движущей силой осмоса является увеличение энтропии, создаваемое движением свободных молекул воды. Также считается, что взаимодействие частиц растворенного вещества с порами мембран участвует в создании отрицательного давления, то есть осмотического давления, управляющего потоком воды.[3] Обратный осмос возникает, когда вода течет в противоположном направлении. При обратном осмосе вода поступает в отделение с более низким осмотическим давлением и более высокой концентрацией воды. Такое течение возможно только при приложении к системе внешней силы. Обратный осмос обычно используется для очистки питьевой воды и требует затрат энергии. [4] Концепцию осмоса не следует путать с диффузией. Диффузия — это чистое движение частиц из области с высокой концентрацией в область с низкой концентрацией. Осмос можно рассматривать как особый тип диффузии. И осмос, и диффузия являются пассивными процессами и включают перемещение частиц из области с высокой концентрацией в область с низкой концентрацией.[2][5]
Диффузия — это чистое движение частиц из области с высокой концентрацией в область с низкой концентрацией. Осмос можно рассматривать как особый тип диффузии. И осмос, и диффузия являются пассивными процессами и включают перемещение частиц из области с высокой концентрацией в область с низкой концентрацией.[2][5]
Сотовый
Скорость осмоса всегда зависит от концентрации растворенного вещества. Этот процесс проиллюстрирован сравнением раствора из окружающей среды или внешнего источника с внутренней концентрацией в организме. Гипертонический раствор — это любой наружный раствор с высокой концентрацией растворенных веществ и низкой концентрацией воды по сравнению с жидкостями организма. В гипертоническом растворе чистое движение воды будет из тела в раствор. Клетка, помещенная в гипертонический раствор, сморщивается и погибает в результате процесса, известного как плазмолиз. Изотонический раствор – это любой раствор для наружного применения, который имеет ту же концентрацию растворенного вещества и воду, что и жидкости организма.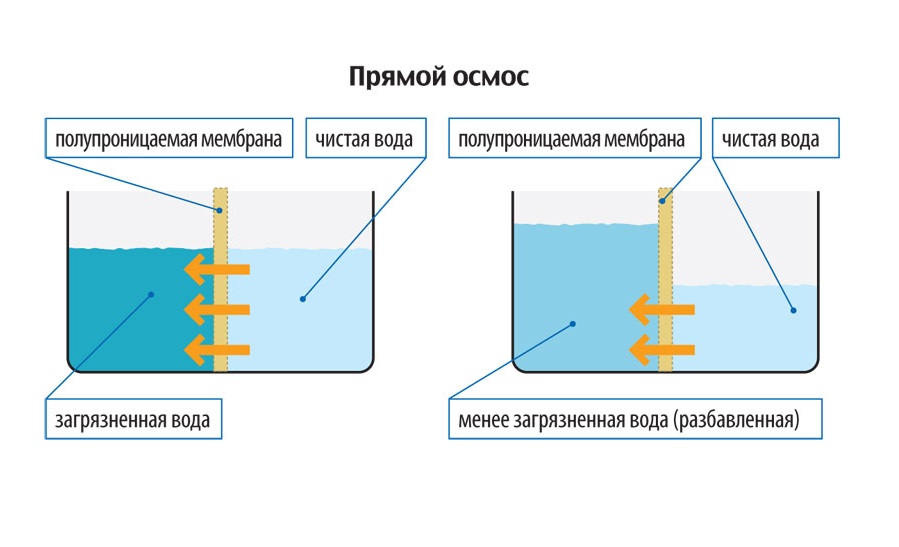
Резюме эритроцитов, помещенных в гипертонические, изотонические и гипотонические растворы
Гипертонический
Гипертонический раствор имеет более высокую концентрацию растворенного вещества по сравнению с концентрацией внутриклеточного растворенного вещества. При помещении эритроцита в любой гипертонический раствор будет происходить движение свободной воды из клетки в раствор. Это движение происходит за счет осмоса, потому что в клетке больше свободной воды, чем в растворе. После того, как растворы уравновесятся, в результате получится ячейка с меньшим общим объемом. Оставшийся объем внутри клетки будет иметь более высокую концентрацию растворенного вещества, и под микроскопом клетка будет выглядеть сморщенной. Раствор будет более разбавленным, чем первоначально. Общий процесс известен как плазмолиз.
При помещении эритроцита в любой гипертонический раствор будет происходить движение свободной воды из клетки в раствор. Это движение происходит за счет осмоса, потому что в клетке больше свободной воды, чем в растворе. После того, как растворы уравновесятся, в результате получится ячейка с меньшим общим объемом. Оставшийся объем внутри клетки будет иметь более высокую концентрацию растворенного вещества, и под микроскопом клетка будет выглядеть сморщенной. Раствор будет более разбавленным, чем первоначально. Общий процесс известен как плазмолиз.
Изотонический
Изотонический раствор имеет ту же концентрацию растворенного вещества, что и внутриклеточная концентрация растворенного вещества. Когда эритроцит помещается в изотонический раствор, чистого движения воды не происходит. Концентрация растворенного вещества и воды одинакова как внутриклеточно, так и внеклеточно; следовательно, не будет чистого движения воды к раствору или к ячейке. Клетка и окружающая ее среда находятся в равновесии, и клетка должна оставаться неизменной под микроскопом.
Гипотонический
Гипотонический раствор имеет более низкую концентрацию растворенного вещества по сравнению с концентрацией внутриклеточного растворенного вещества. Когда эритроцит помещается в гипотонический раствор, в клетку будет поступать свободная вода. Эта ситуация приведет к увеличению внутриклеточного объема с более низкой концентрацией внутриклеточного растворенного вещества. В конечном итоге раствор будет иметь более высокую общую концентрацию растворенного вещества. Под микроскопом клетка может выглядеть наполненной кровью, а клеточная мембрана может в конечном итоге разорваться. Этот общий процесс известен как цитолиз.
Обратите внимание, что осмос представляет собой динамическое равновесие, поэтому в любой момент молекулы воды могут на мгновение течь в любом направлении через полупроницаемую мембрану, но общее суммарное движение всех молекул воды будет происходить из области с высокой концентрацией свободной воды в область низкой концентрации свободной воды.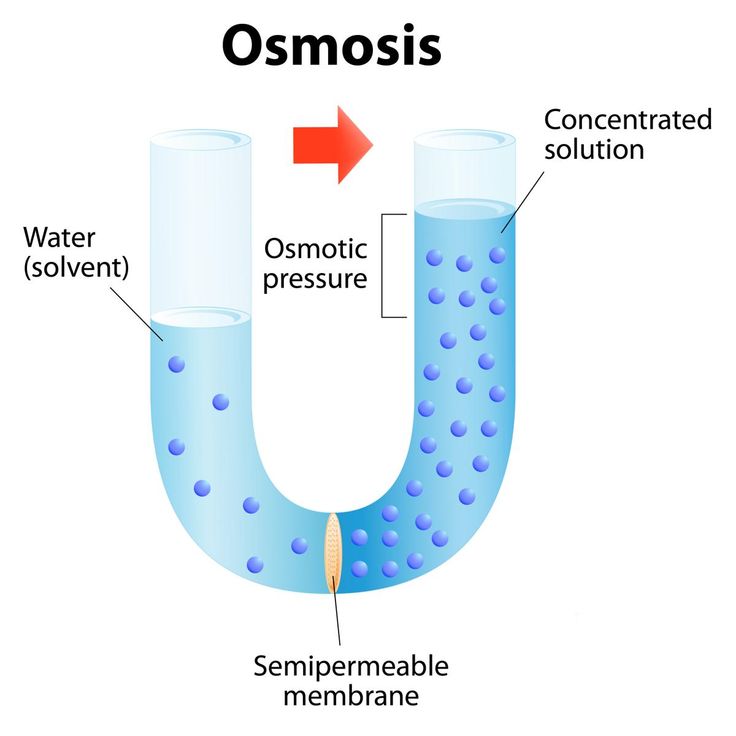 [5][6]
[5][6]
Клиническое значение
Вода известна как «универсальный растворитель», и выживание почти всей известной жизни зависит от нее. Поэтому принцип осмоса, хотя и кажется простым, играет большую роль почти во всех физиологических процессах. Осмос особенно важен для поддержания гомеостаза, который представляет собой тенденцию систем к относительно стабильному динамическому равновесию. Биологические мембраны действуют как полупроницаемые барьеры и позволяют происходить процессу осмоса. Осмос лежит в основе почти всех основных процессов в организме, включая пищеварение, функцию почек, нервную проводимость и т. д. Он позволяет уравновешивать концентрации воды и питательных веществ во всех клетках тела. Это лежащий в основе физический процесс, который регулирует концентрацию растворенных веществ в клетках и вне их, а также помогает выводить лишнюю воду из организма.[2][7][8][9].][10][11]
Контрольные вопросы
Получите бесплатный доступ к вопросам с несколькими вариантами ответов по этой теме.

Комментарий к этой статье.
Рисунок
На изображении показан процесс осмоса. Предоставлено Корнеллом, Б. 2016 г. Ссылка. [ОНЛАЙН] Доступно по адресу: http://ib.bioninja.com.au/standard-level/topic-1-cell-biology/14-membrane-transport/osmosis.html
Ссылки
- 1.
Чен Дж. С., Сабир С., Аль Халили Ю. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 9 мая., 2021. Физиология, осморегуляция и экскреция. [PubMed: 31082152]
- 2.
Марбах С., Бокке Л. Осмос, от молекулярного понимания до крупномасштабных приложений. Chem Soc Rev. 2019 Jun 04;48(11):3102-3144. [PubMed: 31114820]
- 3.
Киил Ф. Молекулярные механизмы осмоса. Am J Physiol. 1989 г., апрель; 256 (4, часть 2): R801-8. [PubMed: 2705569]
- 4.
Гринли Л.Ф., Лоулер Д.Ф., Фриман Б.Д., Маррот Б., Мулен П. Опреснение с помощью обратного осмоса: источники воды, технология и современные проблемы.
 Вода Res. 2009 г.Май; 43 (9): 2317-48. [PubMed: 19371922]
Вода Res. 2009 г.Май; 43 (9): 2317-48. [PubMed: 19371922]- 5.
Гудхед Л.К., MacMillan FM. Измерение осмоса и гемолиза эритроцитов. Adv Physiol Educ. 01 июня 2017 г .; 41 (2): 298–305. [PubMed: 28526694]
- 6.
Мальдонадо К.А., Мохиуддин С.С. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 17 августа 2021 г. Биохимия, гипертонус. [PubMed: 31082139]
- 7.
Киил Ф. Механизм осмоса. почки инт. 1982 февраля; 21 (2): 303–308. [PubMed: 7069994]
- 8.
Меир Э., Перри Дж., Стал Д., Марука С., Клопфер Э. Насколько эффективны смоделированные эксперименты на молекулярном уровне для обучения диффузии и осмосу? Cell Biol Educ. 2005 г. Осень; 4 (3): 235-48. [Бесплатная статья PMC: PMC1200778] [PubMed: 16220144]
- 9.
Шульц С.Г. Эпителиальное водопоглощение: осмос или котранспорт? Proc Natl Acad Sci USA. 2001 Mar 27;98(7):3628-30. [Бесплатная статья PMC: PMC33327] [PubMed: 11274376]
- 10.

Огобуиро И., Тума Ф. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 26 июля 2021 г. Физиология почек. [PubMed: 30855923]
- 11.
Trigo D, Smith KJ. Морфологические изменения аксонов после импульсной активности периферического нерва мыши in vivo: обратный путь для ионов натрия. Дж. Физиол. 2015 15 февраля; 593 (4): 987-1002. [Бесплатная статья PMC: PMC4398533] [PubMed: 25524071]
Copyright © 2022, StatPearls Publishing LLC.
Эта книга распространяется в соответствии с международной лицензией Creative Commons Attribution 4.0 (http://creativecommons.org/licenses/by/4.0/), которая разрешает использование, дублирование, адаптацию, распространение и воспроизведение на любом носителе или формате, при условии, что вы укажете автора(ов) оригинала и источник, будет предоставлена ссылка на лицензию Creative Commons и указаны любые внесенные изменения.
Идентификатор книжной полки: NBK557609PMID: 32491541
In this Page
- Introduction
- Cellular
- Clinical Significance
- Review Questions
- References
Bulk Download
Related information
Аналогичные статьи в PubMed
- Кинетическая модель осмоса через полупроницаемые и проницаемые для растворенных веществ мембраны. [Acta Physiol Scand. 2003]
- Обзор Осмос и сопротивление растворенных веществ: транспорт жидкости и обмен жидкости у животных и растений. [Cell Biochem Biophys. 2005]
- Осмотический поток воды через проницаемые целлюлозные мембраны. [J Gen Physiol. 1960]
- Обзор Развитие идей об осмосе и обмене капиллярной жидкости.
 [FASEB J. 1999]
[FASEB J. 1999] - Молекулярные механизмы осмоса. [Am J Physiol. 1989]
Просмотреть отзывы… Просмотреть все…
Последние действия
ClearTurn OffTurn On
Ваша активность в Интернете пуста.
Запись активности отключена.
Включить запись
Подробнее…
Осмос: определение, процесс, примеры | Наука
Обновлено 26 марта 2019 г.
Автор: Мелисса Майер
Большинство людей знают, что растениям нужна вода, чтобы выжить, но выяснить, как часто их поливать, может быть сложно как для ботаников, так и для любителей растений. Один простой трюк — отметить в календаре, когда вы поливаете свое растение, а затем подождать, пока оно не начнет увядать, чтобы рассчитать, как долго ждать между сеансами полива. Идеальное время – непосредственно перед тем, как растение увянет.
Наука, почему это работает? Клеточные мембраны и осмос .
Всем клеткам необходимо перемещать молекулы внутрь и наружу. Некоторые механизмы для достижения этого требуют, чтобы клетка использовала энергию, например, установка насосов в клеточной мембране для транспортировки молекул.
Диффузия — это способ бесплатного перемещения некоторых молекул через мембрану — из областей с более высокой концентрацией растворенных веществ в области с более низкой концентрацией, не требуя от клетки затрат ценной энергии. Осмос очень похож на диффузию, но вместо молекул или растворенного вещества он перемещает растворитель, то есть чистую воду.
Процесс осмоса
Полупроницаемые мембраны, подобные тем, которые имеются в клетках животных и растений, отделяют внутреннюю часть клетки от того, что находится вне клетки. Процесс осмоса перемещает молекулы воды через полупроницаемую мембрану , когда существует градиент концентрации, так что на каждой стороне биологической мембраны имеются разные концентрации растворенного вещества.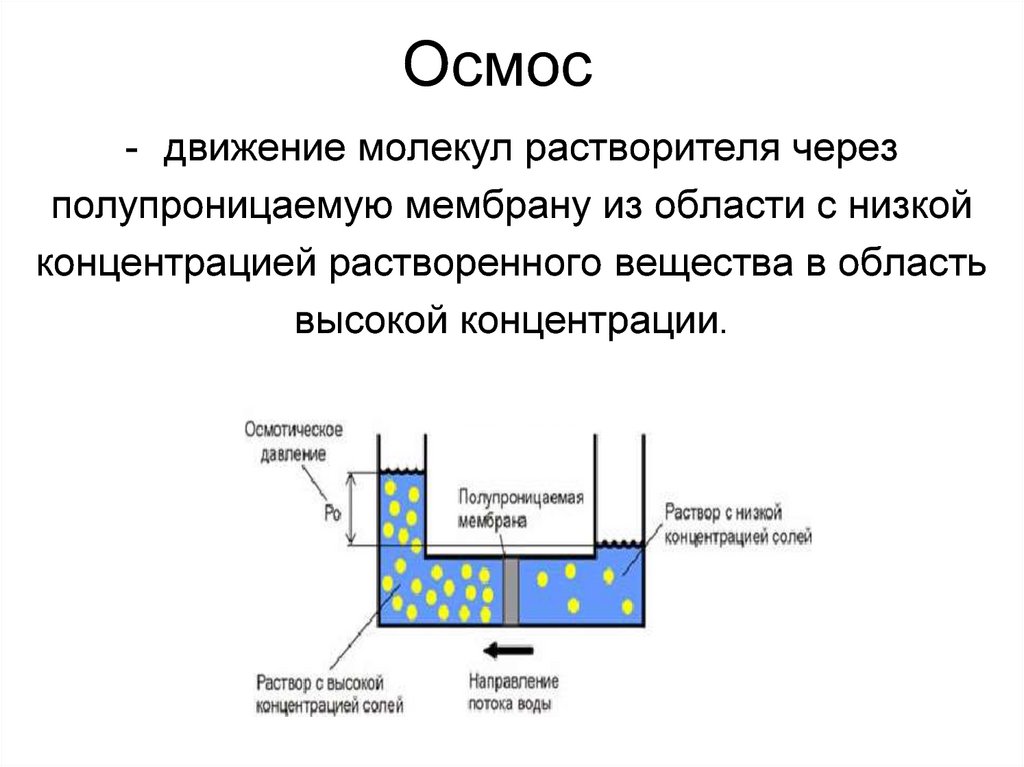
Осмотическое давление будет просто перемещать молекулы воды через мембрану до тех пор, пока растворенное вещество (молекула, растворенная в воде) не достигнет равновесия. В этот момент количества растворенного вещества и растворителя (воды) равны по обе стороны мембраны.
Например, рассмотрим раствор соленой воды, в котором соль растворена в воде через мембрану. Если на одной стороне мембраны концентрация соли выше, вода перемещается от менее соленой стороны через мембрану к более соленой до тех пор, пока обе стороны мембраны не станут одинаково солеными.
Три типа осмоса Примеры
В процессе осмоса клетки могут сжиматься или расширяться (или оставаться неизменными) при движении молекул воды. Осмос влияет на клетки по-разному в зависимости от типа рассматриваемого раствора.
В случае гипертонического раствора вне клетки больше растворенного вещества, чем внутри клетки.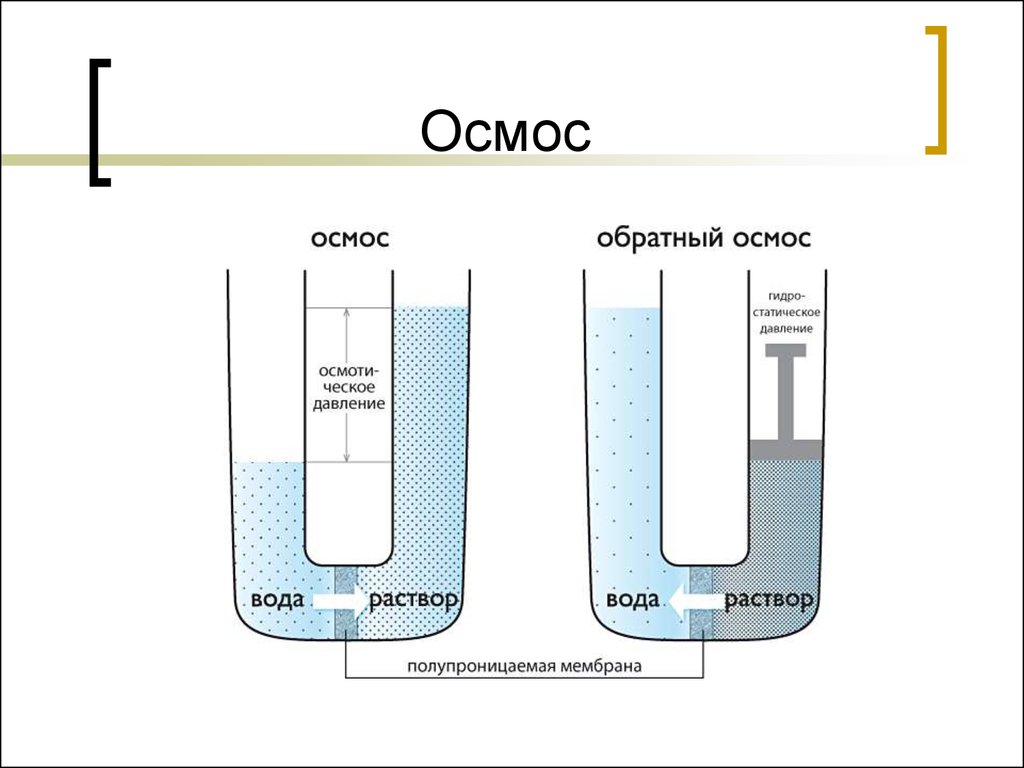 Чтобы уравновесить это, молекулы воды покидают клетку, двигаясь к стороне мембраны с более высокой концентрацией растворенного вещества. Эта потеря воды заставляет клетку сжиматься.
Чтобы уравновесить это, молекулы воды покидают клетку, двигаясь к стороне мембраны с более высокой концентрацией растворенного вещества. Эта потеря воды заставляет клетку сжиматься.
Если раствор является гипотоническим раствором , внутри клетки больше растворенного вещества, чем снаружи клетки. Чтобы найти равновесие, молекулы воды движутся в клетку, заставляя клетку расширяться по мере увеличения объема воды внутри клетки.
Изотонический раствор содержит одинаковое количество растворенного вещества с обеих сторон клеточной мембраны, поэтому эта клетка уже находится в равновесии. Он останется стабильным, не уменьшится и не набухнет.
Как осмос влияет на клетки
Хорошей моделью для понимания того, как процесс осмоса влияет на клетки человека, является эритроцит. Тело усердно работает, чтобы поддерживать 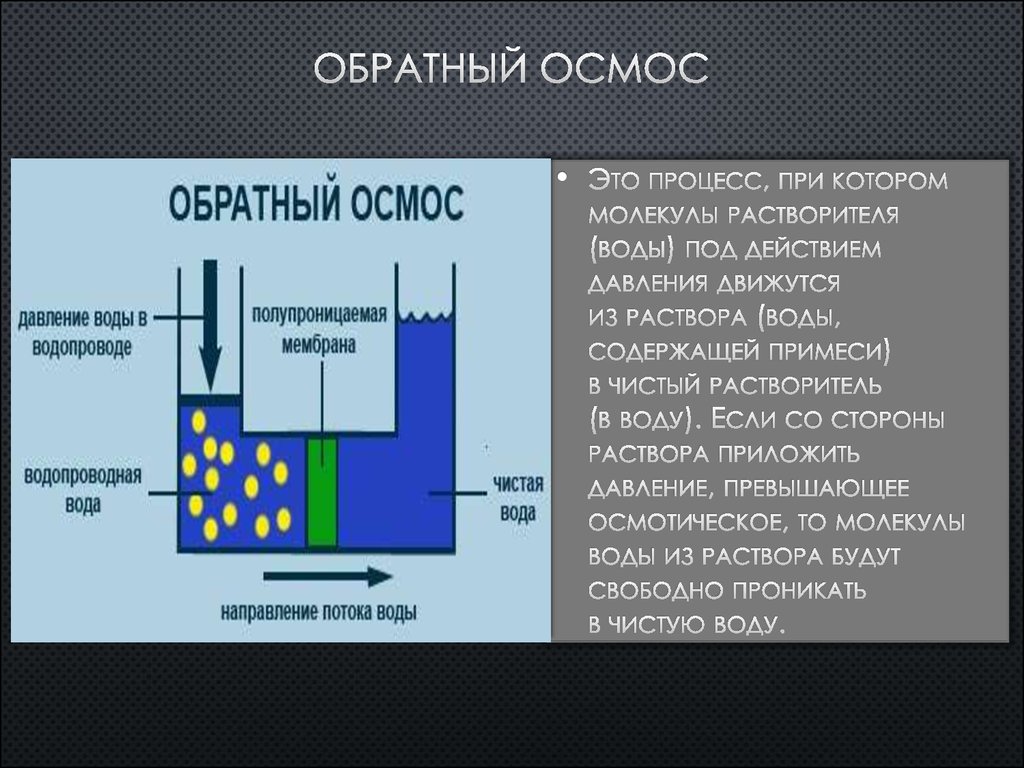

 Вода Res. 2009 г.Май; 43 (9): 2317-48. [PubMed: 19371922]
Вода Res. 2009 г.Май; 43 (9): 2317-48. [PubMed: 19371922]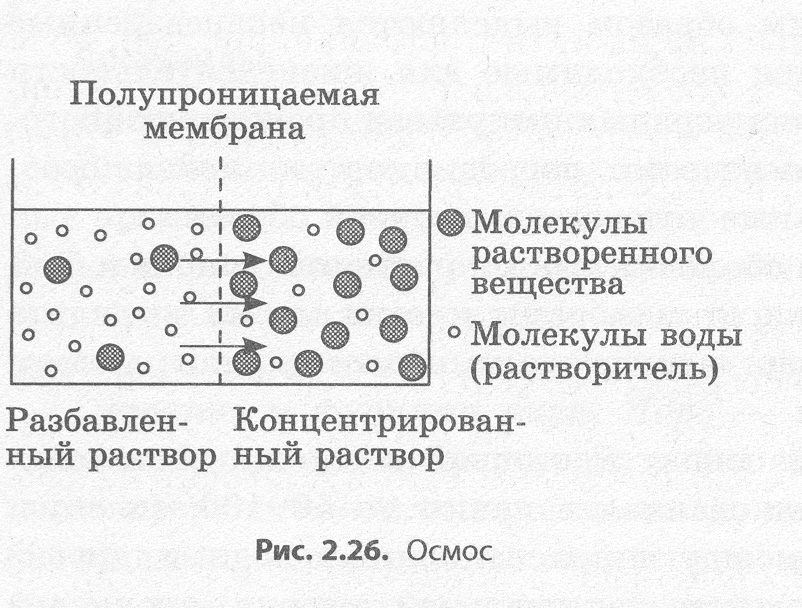 [FASEB J. 1999]
[FASEB J. 1999]